Introduction aux prothèses de genou
Une mise au point sur cette chirurgie est nécessaire car la qualité des résultats repose sur une grande rigueur dans l’indication, le choix de la prothèse, et la technique chirurgicale.
Après des débuts difficiles dans les années 70,dont les précurseurs sont J. Insall et M. Freedman, des progrès considérables ont été faits grâce à la meilleure connaissance de l’anatomie du genou qui reste et de sa biomécanique.
L’amélioration du dessin de la prothèse, de son intégration dans l’équilibre ligamentaire et la qualité des matériaux ont permis de rendre cette intervention chirurgicale fiable.
CLASSIFICATIONS ET CHOIX DES IMPLANTS
Les prothèses se repartissent en trois grandes classes :
1. Unicompartimentale
2. Bicompartimentale
3. Tricompartimentale
a Non contrainte
b Semi contrainte
c Contrainte
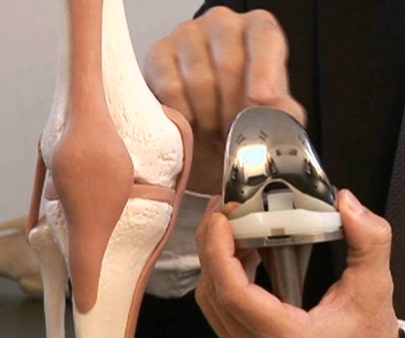
1. Les prothèses uni-compartimentales
Les prothèses uni-compartimentales remplacent la surface articulaire d’un seul compartiment interne ou externe. Le resurfaçage est limité au compartiment lésé sans toucher aux ligaments, ni aux autres compartiments qui doivent donc être sains. On peut également intégrer la prothèse fémoro-patellaire dans cette classification.
2. Les prothèses bicompartimentales
Beaucoup de prothèses totales de genou de première génération étaient dessinées et destinées à remplacer les deux surfaces articulaires du fémur et du tibia sans remplacement de l’articulation fémoro patellaire mais rapidement étant donné les résultats médiocres obtenues avec les bicompartimentales, les prothèses ont été conçues pour être tricompartimentales.
3 Les prothèses tricompartimentales
Il faut séparer les prothèses à glissement plus ou moins contraintes selon que l’on respecte un ou les deux ligaments croisés aux prothèses charnières (contraintes)
Le principe est un remplacement des trois surfaces articulaires par une prothèse condylienne fémorale métallique qui s’articule sur un plateau tibial en polyéthylène et un médaillon rotulien également en polyéthylène.
Il existe trois types de prothèse à glissement (avec plateau fixe ou mobile)
a Les prothèses non contraintes
Les prothèses non contraintes : c’est un « resurfaçage » des trois surfaces articulaires avec conservation de tous les ligaments du genou et notamment des ligaments croisés. C’est la seule prothèse qui permet de redonner une cinématique normale du genou(2) mais elle est rarement utilisée car techniquement difficile et que dans 40% des cas, le ligament croisé antérieur a disparu.
Les prothèses à conservation du ligament croisé postérieur : la contrainte des deux éléments prothétiques est minime, le respect du LCP permet le mouvement de roulement glissement rotation en s’opposant à la translation postérieure du tibia en flexion.
Les plateaux sont moins congruents sans came centrale.
b Les prothèses semi-contraintes
b Les prothèses semi-contraintes : le dessin des implants (plateau concave) assure une certaine stabilité au genou. La résection du ligament croisé postérieur nécessite une came intercondylienne ayant un effet de butée postérieur en flexion (6). Actuellement de plus en plus de ces prothèses sont dessinées sans came mais avec un plateau très concave avec rayon sagittal polycentrique (prothèses ultracongruentes)
c Les prothèses contraintes
Les prothèses contraintes : prothèses charnières
Véritables charnières, elles sont constituées de deux éléments tibial et fémoral comportant une longue tige centro-médullaire, et un système d’axe (palier) autorisant les mouvements de flexion-extension. (Groupe Guépard 1970) Les plus récentes ont évolué en permettant grâce à un double système d’axe d’avoir des mouvements de flexion-extension et de rotation (prothèse semi-charnière et à pivot).
Elles ont un certain nombre d’inconvénients :
- Un sacrifice osseux important
- Risque d’embolie graisseuse au moment du scellement (choc peropératoire)
- Risque de sepsis post opératoire plus important.
Mais surtout un taux élevé de descellement et de fracture lié à l’importance des contraintes reportées au niveau des tiges.
Des problèmes de corrosion (paliers métalliques) et d’usure (paliers en polyéthylène) au niveau de l’axe (1,3).
Ces prothèses restent cependant indiquées pour le traitement des tumeurs osseuses ou dans les destructions osseuses ou ligamentaires majeures ( reprise de prothèse)
Les plateaux mobiles
Depuis plus de 20 ans maintenant sont apparues les prothèses à plateau mobile avec ou sans conservation des croisés. Elles ont un mouvement de translation antéro-postérieure, de rotation ou mixte. Actuellement les prothèses mobiles les plus utilisées sont ultracongruentes à rotation axiale pure. Il semble que la mobilité de l’insert diminue les contraintes aux interfaces et donc l’usure du polyèthylène. (13)
Les prothèses de reprise
Ce sont le plus souvent des prothèses à glissement postéro-stabilisées avec adjonction de tiges centro-médullaires plus ou moins longues pour assurer la stabilité osseuse. On utilise des cales métalliques adaptées aux systèmes prothétiques pour combler des pertes osseuses et parfois des greffes osseuses.
LA FIXATION DES IMPLANTS
Deux techniques : les prothèses cimentées et non cimentées
Prothèses cimentées :
Le ciment est une résine acrylique de polyméthylmétacrylate. Sa polymérisation en quelques minutes, réalise une tenue quasi immédiate de la prothèse.
Prothèses sans ciments :
L’accrochage primaire entre la prothèse et l’os se fait par impaction, l ‘accrochage secondaire se fait par une repousse osseuse au contact de l’implant par l’intermédiaire d’irrégularité de surface ou d’un revêtement ostéoconducteur favorisant la repousse osseuse (hydroxyapatite).
Cela nécessite un os de bonne qualité avec un ajustage parfait.
Actuellement la tendance serait d’associer une pièce fémorale non cimentée avec les pièces tibiale et patellaire cimentées (prothèse hybride)
La gonarthrose :
Primitive ou secondaire, la gonarthrose est l’indication la plus fréquente d‘arthroplastie totale du genou.
Lorsque l’arthrose ne concerne qu’un seul compartiment, la prothèse totale n’est pas toujours indiquée.
En effet, une gonarthrose fémoro-tibiale interne chez un patient jeune avec un genu varum doit faire discuter une ostéotomie tibiale de valgisation. Lorsque l’indication est bien posée, elle permet d’obtenir plus de 80% de bon résultat à 10 ans.
On peut également proposer une prothèse unicompartimentale (PUC) chez des sujets plus âgés et sédentaires car les suites sont en général plus simples, avec une reprise précoce de l’appui.(22)
L’arthrose fémoro-patellaire isolée est difficile à traiter, car les résultats des prothèses fémoro- patellaires bien qu’encourageant ne sont pas excellents, actuellement plusieurs équipes proposent de faire d’emblée une prothèse totale de genou avec un meilleur résultat.
Dans tous les cas l’indication de PTG n’est posée qu’après un traitement médical bien conduit ( antalgiques, anti-inflammatoires, infiltrations, visco-supplémentations, lavages articulaires) ou traitement chirurgical conservateur (ostéotomie)
La polyarthrite rhumatoïde :
La polyarthrite rhumatoïde :
L’atteinte du genou est rarement isolée et rentre dans le cadre d’une atteinte polyarticulaire chez des patients fragiles. L’indication peut être posée au stade inflammatoire ou au stade de séquelles. Il faut opérer rapidement ces patients avant d’avoir des destructions osseuses majeures car la chirurgie devient plus difficile avec utilisation d’implants massifs, de greffe osseuse parfois même de prothèses à charnière.
L’objectif est de restituer au patient une indolence et une autonomie précoce chez ces patients souvent multi opérés.
Les autres rhumatismes inflammatoires :
Plus rare, ils ont les mêmes indications.
La nécrose :
Elle touche le plus souvent le condyle interne, c’est une bonne indication d’une PUC, mais uniquement si la nécrose n’est pas étendue. Dans le cas contraire, il est préférable de réaliser une PTG d’emblée car le risque de descellement de l’implant fémoral est important, en effet l’os sous la nécrose étant de mauvaise qualité.
Il faut discuter une ostéotomie chez les sujets jeunes.
Les tumeurs :
La prise en charge doit toujours se faire dans un centre spécialisé par une équipe multidisciplinaire. Elle comprend en général l’utilisation d’une prothèse charnière permettant des résections tumorales larges avec parfois l’utilisation de d’allogreffe massive pour la reconstruction osseuse.
BILAN PREOPERATOIRE
Il doit être local complet et général :
Un examen clinique est nécessaire afin d’évaluer la mobilité du genou, l’état ligamentaire du genou, l’état trophique des membres inférieurs (états cutané et veineux). L’imagerie comportera :
- une radiographie du genou de face en charge et incidence de Schuss,
- une radiographie de profil à 30° de flexion,
- une vue axiale des rotules à 30° de flexion,
- une goniométrie de face de l’ensemble des deux membres inférieurs
- afin d’évaluer l’axe mécanique du membre.
Parfois une radiographie de face en position de correction de la déviation ( stress en valgus ou en varus) est utile. En revanche une IRM n’est pas indiquée.
Dans le bilan général, l’évaluation de l’état cardiovasculaire est indispensable, ainsi que la recherche et l’éradication de tous les foyers infectieux notamment urinaire. Suite au bilan général, la consultation d’anesthésie décidera du type d’anesthésie (ARL ou AG) et de l’intérêt ou non de l’autotransfusion.
INTERVENTION
Elle est réaliser dans un bloc opératoire de chirurgie orthopédique prothétique avec un flux laminaire ou système de ventilation « système classe 100 », (nombre de particules dans un mètre cube d’air) alors qu’un « système classe 1000 » est suffisant pour les arthroscopies.
Le membre est lavé, rasé, désinfecté à la bétadine et entouré de champs stériles.
L’intervention se fait le plus souvent sous garrot.
Les différentes coupes osseuses sont réalisées à l’aide d’une instrumentation adaptée à la prothèse choisie ( matériel ancillaire), il faut bien veiller à l’équilibre ligamentaire et si nécessaire faire des libérations (release) plus rarement des retentions ligamentaires.
Actuellement de plus en plus de prothèses sont proposées avec un matériel ancillaire assisté par ordinateur. Le chirurgien reste l’opérateur mais l’ordinateur le guide pas à pas dans ces coupes osseuses. Le principe consiste à reconstruire une image en trois dimensions du genou opéré puis grâce à un système de capteur fixé provisoirement sur le genou, l’ordinateur guide dans l’espace la réalisation du geste opératoire.
Ce système est peu répandu et en cours d’évaluation.
SUITES OPERATOIRES

L’antibioprophylaxie est débutée au bloc opératoire avant le gonflage du garrot et poursuivie pendant 48 heures en post opératoire. Un drainage par redon est laissé 2 à 3 jours. Certaines équipes mettent en place des cathéters cruraux permettant une rééducation précoce non douloureuse.
La rééducation est débutée dès le lendemain avec mobilisation du genou ( manuel ou Kinetec). Le lever est autorisé le 2e ou 3e jour avec un appui complet avec 2 cannes béquilles.
Le patient sort vers le 12e jour. La rééducation se poursuit pendant plusieurs semaines en centre puis à domicile.En règle générale la flexion atteint 90° entre le 10e le 30e jour.
Lorsque la flexion reste très limitée au 21e jour, une mobilisation sous anesthésie générale peut être préconisée. Le patient est revu en consultation pour un bilan radioclinique à 6 semaines puis à 3 mois, 6 mois, 1 an puis tous les 2 ans.
COMPLICATIONS
GENERALES
Thromboemboliques
Probablement sous estimées car souvent asymptomatiques(14, 15 ), leurs incidences restent faibles en l’absence de facteurs de risques majeurs (obésité, insuffisance veineuse, antécédent de phlébite) Une prophylaxie systématique doit être instaurée par héparine de bas poids moléculaire, un lever précoce et le port de bas de contention en post opératoire.
Hémorragiques
Les pertes sanguines post opératoires peuvent être importantes, elles sont limitées par un système de drainage récupérateur (cell sever) ou compensées par l’auto transfusion.
Embolies Graisseuses
Elles sont exceptionnelles, et sont surtout décrites au moment du scellement des prothèses à longue tige. (Prothèse Guépard)
COMPLICATIONS
LOCOREGIONALES
PRECOCES
Hémarthroses et hématomes
Hémarthroses et hématomes ne sont pas rares et sont bien soulagés par le « glaçage » du membre opéré. S’ils sont volumineux, il peut être nécessaire de les ponctionner, voir de les évacuer chirurgicalement.
Nécroses et désunions cutanés,
Nécroses et désunions cutanés, peuvent mettre en jeu le devenir de la prothèse sous jacente. En cas d’atteinte limitée, l’évolution est souvent favorable après arrêt de la rééducation et soins locaux. Cependant, elles peuvent parfois nécessiter un geste chirurgicale (nouvelle suture) ou un geste plastique (lambeaux de recouvrement).
Paralysies nerveuses
Paralysies nerveuses sont très rares, (étirement du nerf sciatique poplité externe après réduction d’un grand genu valgum ou flessum)
Infectieuses
Le risque infectieux est une complication rare mais grave qui impose le plus souvent une réintervention (pour nettoyer l’articulation opérée et parfois changer la prothèse) ainsi qu’une antibiothérapie prolongée.
Le taux d’infection est d’environ 2%, ce risque augmente sur certains terrains (polyarthrite rhumatoïde 8% (4), corticothérapie, diabète) ou lors d’une réintervention.
L’infection peut survenir précocement (infection aiguë) avant la 3e semaine post opératoire, elle est due à une contamination du site opératoire, habituellement par la peau.
Elle peut être subaiguë (survenant dans les deux ans) ou tardive dans ces cas il s’agit le plus souvent de contamination hématogène ou lymphatique à partir d’un foyer infectieux à distance.
Il est indispensable de faire le diagnostique précocement afin de réaliser un traitement approprié et efficace. La clinique (fièvre, douleur et signes locaux), la biologie (VS, CRP), la scintigraphie osseuse aux leucocytes marqués et surtout la ponction articulaire afin d’isoler le germe permettrons de confirmer le diagnostique. (7)
Le traitement associe toujours un geste chirurgical et une antibiothérapie prolongée.
Dans l’infection aiguë débutante le lavage débridement synovectomie du genou sans changement de la prothèse peut permettre la guérison.
Dans les autres cas l’ablation de la prothèse est indispensable.La nouvelle prothèse peut être réimplantée dans le même temps opératoire ou à distance après normalisation de la biologie.(5)
COMPLICATIONS
LOCOREGIONALES
TARDIVES
La raideur
La raideur est une limitation de flexion inférieure à 90, elle est souvent du à une rééducation post opératoire insuffisante ou arrêtée. Une mobilisation précoce sous anesthésie générale avec poursuite de la rééducation permet dans la majorité des cas de récupérer la mobilité.
Le syndrome neuro-algo-dystrophique
Le syndrome neuro-algo-dystrophique est rare, il nécessite un traitement médical prolongée
Les fractures
Les fractures sont rares et le plus souvent traumatiques. Les fractures peropératoires sont exceptionnelles et sont favorisées par un os ostéoporotique.
Les instabilités et luxations
Les instabilités et luxations du genou sont la conséquence d’un mauvais équilibre ligamentaire ou d’une malposition des implants. Elles peuvent nécessiter une reprise chirurgicale.
L’usure
L’usure de la prothèse est la complication majeure à long terme Elle est inéluctable.
Elle est longtemps asymptomatique.
Elle est, par la libération des particules d’usure, à l’origine d’une réaction inflammatoire péri prothétique avec ostéolyse responsable d’un descellement.
Le descellement
Le descellement peut être secondaire à l’ostéolyse péri-prothétique ou à des contraintes excessives (prothèse charnière ou malposition de l’implant) se traduisant par l’apparition de douleur et d’un liseré clair radiologique à l’interface os-implants. Un descellement précoce doit toujours faire rechercher une infection. La migration des implants impose une reprise chirurgicale (RPTG) ;
RESULTATS CLINIQUES
Les résultats des différentes séries sont difficiles à analyser. Les critères d’évaluation ne sont pas les mêmes. Les courbes de survie prennent le plus souvent comme critère d’échec, le remplacement prothétique et non le descellement ou l’usure.
Néanmoins, l’analyse des résultats publiés montre des courbes de survie comprises entre 93,5% et 96,8 % à 15 ans et des études récentes (8 11 12) montrent un taux de survie compris entre 90,77% et 93,6% à 20 ans.(9 10). Dans l’étude de Insall , à 21 ans il a un taux de survie de la prothèse de 90,77 % et le taux d’échec est indépendant de l’âge, de la pathologie ayant nécessite la prothèse et enfin du poids. (10)
Plus de 90 % des patients ayant une prothèse totale de genou ont un résultat fonctionnel satisfaisant à 15 ans, c’est à dire un genou indolore et une flexion supérieure à 90°.
La douleur est le critère principal dans le résultat d’une prothèse, dans 90 % des cas le genou est indolore (parfois présence de quelques douleurs climatiques (30%)ne nécessitant pas la prise d’antalgique), dans 10% des cas les douleurs sont plus importantes et justifie un traitement médical simple.
La mobilité est le deuxième critère, la récupération de la mobilité est bonne et les différentes publications montrent une récupération d’une flexion moyenne de l’ordre de 120°. (12)
Le patient porteur d’une prothèse totale de genou peut avoir une vie quotidienne normale avec une marche sans canne sans limitation de la distance parcourue, et parfois reprendre une activité physique sportive raisonnable (randonnée, natation, vélo, golf…)
L’usure du polyéthylène
L’usure de la prothèse est la complication majeure à long terme. L’utilisation du polyéthylène comme interface de glissement dans les prothèses est universelle, contrairement à la hanche où l’on utilise d’autre couple de friction (métal-métal, alumine-alumine).
L’amélioration de la qualité du polyéthylène (pureté, haute densité ) et une épaisseur suffisante > 8 mm limite l’usure.
Les liserés
Le problème du liseré radio-transparent dans les arthroplasties scellées du genou est probablement surestimé ; beaucoup d’auteurs ont échoué à mettre en évidence toute corrélation entre l’existence d’un liseré, sa progression, et le résultat clinique.
Habituellement ces liserés apparaissent rapidement et progressent rarement.
Reprises
En cas d’usure du plateau sans descellement une reprise avec changement de l’insert en polyéthylène est une intervention simple dont les suites donnent d’excellent résultat.
En revanche en cas de descellement avec migration des implants, la réintervention est souvent difficile en raison des dégâts osseux et de la déformation. On utilise des implants modulables avec tige centromédullaire et cales métalliques pour combler les pertes osseuses. Parfois l’utilisation de greffes osseuses est nécessaire ou même de prothèses charnières.
Plateau mobile oui ou non ?
Les prothèses totales de genou à plateau mobile ont une durée de vie équivalente à celle des PTG à plateau fixe. Il semble que la mobilité de l’insert diminue les contraintes aux interfaces et donc l’usure du polyèthylène. (13)
Les seules complications que l’on puisse attribuer de façon spécifique à la mobilité du plateau sont les luxations de l’insert ou les luxations fémoro-tibiales.
Conservation du LCP oui ou non ?
Le taux de liseré tibial semble inférieur avec les prothèses à conservation du LCP. En effet, Ewald ( 17) et Laskin ( 18) rapportent toujours moins de 30 p. 100, alors que Huten ( 19) et Insall (20) observent 40 p. 100 et plus de liserés. Toutefois Stern et Insall ( 20 21) ont rapporté récemment un taux de survie de 94 p. 100 à 12 ans très rassurant quant à l’ influence de la substitution du LCP sur la longévité du scellement tibial.
Finalement nous pensons qu’il ne semble pas exister d’argument clinique notable à moyen
terme plaidant en faveur de la conservation du LCP, d’autant que la technique opératoire est plus difficile.
CONCLUSION
Les progrès dans la conception, les matériaux utilisés et la technique de pose des prothèses du genou ont permis de rendre cette intervention sûr et fiable à long terme (20 ans). Avec les modèles récents on obtient d’excellent résultat, le genou étant stable, mobile et indolore.
Néanmoins, elle reste une chirurgie délicate, et impose une grande rigueur dans l’indication, le choix des implants et la technique chirurgicale.
BIBLIOGRAPHIE
1 Aubriot JH, Huten D, Hernigou Ph, Pelisse F, Marie F, Les prothèses du genou. In : Conception des prothèses articulaires, cahier d’enseignement de la SOFCOT. Paris : Expansion scientifique française 1993 ; 44 : 91-140
2 Stiehl JB, Komistek FD, Cloutier JM, Dennis DA, The cruciate ligaments in total knee arthroplasty : a kinematic analysis of 2 total knee arthroplaties. J Arthroplaty. 2000 aug ; 15(5) : 545-50
3 Mascard E, Anract P, Touchene A, Pouillard P, Tomeno B, Complication from the hinged Guepar prosthesis after rescetion of knee tumor. 102 cases Rev Chir Orthop 1998; 84(4): 628-37
4 Laskin RS: Total condylar knee replacement in patients who have R.A. A ten year follow-up study. J Bone Joint Surg 72 A: 529-535, 1990.
5. Matthieu M. Les prothèses totales du genou infectées. In : Cahier d’enseignement de la SOFCOT. Paris : Expansion scientifique française 1995 ; 52 : 51-61
6. INSALL JN, LACHIEWIECZ FP, BURNSTEIN AH : The posterior stabilized
condylar prosthesis. J Bone Joint Surg ( Am), 1982, 64, 1317.
7. Tsukayama DT, Golderberg VM, Kyle R, Diagnosis and management of infection after total knee arthroplasty. J Bone Joint Surg 2003 ; 85-A Suppl 1 : S75-80
8 Vazquez-Vela Johnson G, Worland RL, Keenan J, Norambuena N : Patient demographics as a predictor of the ten-year survival rate in primary total knee replacement. J Bone Joint Surg 2003 (Br) jan;b 85(1) 52-6
9 Rodriguez JA, Bhende H, Ranawat CS: total condylar knee replacement: a 20-year followup study.Clin orthop 2001 July; (388):10-7
10 Font-Rodriguez DE, Scuderi GR, Insall JN: Survivorship of cemented total knee arthroplasty. Clin Orthop 1997 Dec; (345): 79-86
11 Ritter MA, Berend ME, Meding JB, Keating ME, Faris PM, Crites BM, Long term followup of AGC PCL retaining total knee replacement Clin Orthop 2001 July (388): 51-57
12 Hoffman AA, Evanich JD, Ferguson RP, Camargo MP: Ten to 14 year clinical followup of cementless natural knee system Clin Orthop (388) July 85-94
13 argenson JN, O’Connor JJ: polyethylene wear in meniscal knee replacement J Bone Joint Surg 1992 Mars 74 B (2) 228-232
14 Grady_Benson JC, Oishi CS, Hanson PB, Colwell CW Jr, Otis SM, walker RH; Post operative surveillance for deep venous thrombosis with duplex ultrasonography after total knee arthroplasty. J Bone Joint Surg 1994 A 76 (11) 1649-57
15 Berry DJ; Surveillance for venous thromboembolic disease after total knee arthroplaty. Clin Orthop 2001 Nov (392): 257-66
16 Price AJ, Rees JL, Beard D, Juszczak E, Cater S, White S, De Steig R, Dood CA, Gibbons M, Mc Lardy-Smith P, Goodfellow JW, Murr DW; A mobile-bearing total knee prosthesis compared with a fixe bearing prothesis. A multicentre single-blind randomised controlled trial. J Bone Joint Surg Br 2003 Jan ; 85 (1):62-7
17. EWALD FC, JACOBS MA, MIEGEL RE : Kinematic total knee replacement. J Bone
Joint Surg ( Am), 1984, 66, 1032-1039.
18. LASKIN RS : R. M. C. total knee arthroplasty. J Arthroplasty, 1986, 1, 91-98.
19. HUTEN D, DUPARC J : Prothèse tricompartimentale Mark II de Freeman et
Samuelson. Cahier d’ enseignement de la SOFCOT 35, 69-82 Expansion Scientifique
Française, Paris, 1988.
20. INSALL JN, MOOD RW, FLAWN LB, SULLIVAN DJ : The total condylar knee
prosthesis in gonarthrosis. A five to nine year follow-up of the first one hundred consecutive
replacements. J Bone Joint Surg ( Am), 1983, 65, 619-628.
21. STERN SH, INSALL JN : Posterior Stabilized Prosthesis. Results after follow-up of
nine to twelve years. J Bone Joint Surg ( Am), 1992, 74, 980-986.
22 ; Witvoet J, Peyrache MD, Nizard RS. Prothèses unicompartimentaires du genou type lotus dans le traitement des gonarthroses latéralisées. Résultats de135 cas avec un recul moyen de 4,6 ans. Rev Chir Orthop 1993 ; 79: 565-76.

Docteur Nicolas LEFEVRE, Docteur Yoann BOHU, Docteur Serge HERMAN. – 7 octobre 2012.

